crecimiento bacteriano
Curso de Microbiología
domingo, 26 de octubre de 2014
Dilucion Bacteriana
Técnica de Recuento por Dilución
Mediante el uso de esta técnica de simple ejecución y fácil interpretación, se pueden evaluar diferentes grupos bacterianos según el medio de cultivo que contenga el frasco.
Es aplicable para evaluar bacterias heterotróficas, aerobias totales (BAT), bacterias reductoras de sulfato (BRS), anaerobias heterotróficas totales (BAnT), etc.
Esta técnica está recomendada por el Instituto Americano del Petróleo (API) para evaluar calidad biológica en aguas de inyección en recuperación secundaria y también es ampliamente usada en evaluación de problemas microbiológicos en aguas de refrigeración.
Procedimiento.
La técnica de dilución por extinción consiste en inocular una serie de frascos tipo antibiótico que contienen 9 ml del medio de cultivo apropiado según el tipo de bacteria que se quiera evaluar.
Se obtiene 1 ml de la muestra usando una jeringa descartable, estéril, de 1 o 2 ml de capacidad.
Se inocula el primer frasco, sin retirar la aguja se agita el mismo, se invierte y se retira 1 ml que se inocula en el 2° frasco.
Con una nueva jeringa, se retira 1 ml del frasco N° 2, previamente agitado, y se inocula el frasco N° 3 y así sucesivamente, utilizando una nueva jeringa para cada frasco.
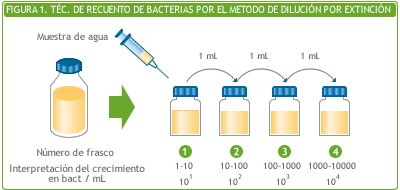 Si no existe información previa sobre cantidad de bacterias/mL de la muestra suelen sembrarse 6 frascos.
Si no existe información previa sobre cantidad de bacterias/mL de la muestra suelen sembrarse 6 frascos.
La manifestación de crecimiento bacteriano se observa por la turbidez del medio de cultivo que se compara por transparencia con un frasco sin inocular en el caso de bacterias aerobias totales y bacterias anaerobias totales; en el caso de bacterias reductoras de sulfatos se debe observar un ennegrecimiento del frasco.
Una vez inoculados los frascos y rotulados convenientemente, se incuban durante 7 días (BAT, BAT-RF, MFT) o 14 días (BPA) en estufa de cultivo a ±5ºC respecto de la temperatura del agua muestreada,
efectuando lecturas diarias para observar aquellos frascos que manifiestan desarrollo positivo. Para el caso de los medios BRS y BRH, el plazo de lectura es de 28 días máximo, realizando también lecturas periódicas..
Cálculos de densidad bacteriana.
Se tienen en cuenta los frascos que manifiesten alguna modificación como consecuencia del crecimiento bacteriano; esta modificación puede ser turbidez, cambio de color, ennegrecimiento, etc.
Por ejemplo: si se usó el medio BAT-RF y se observa turbidez y/o cambio de color hasta el frasco N° 4 el resultado sería 1000-10000 bact/mL o exponencialmente 103-104 bact/mL.. Habitualmente se informa 104 bact/mL.
Problemas comunes en la interpretación del crecimiento bacteriano cuando se utiliza la técnica de dilución por extinción.
Hay una variedad de acontecimientos que interfieren con la interpretación de resultados obtenidos utilizando las diluciones seriadas. Algunos de los mas comunes son:
· Todos los frascos muestran crecimiento.
Si esto sucede, no es posible estimar la población, por ejemplo si en una serie de 6 frascos inoculados todos se manifiestan positivos se debe informar:106 bact/mL. Para el próximo análisis de esa muestra habría que considerar el empleo de 8 o 9 frascos.
· Un frasco no denota crecimiento y el resto sí.
Algunas veces uno de los frascos permanece sin cambios mientras que los ubicados anterior y posteriormente en la serie inoculada muestran positividad. Es decir, hay un “salto” en los frascos positivos. Este “salto” debe ser anotado y se informará la concentración bacteriana correspondiente al frasco de mayor numeración que resultó positivo. Por ejemplo: El crecimiento positivo se observa en los frascos 1, 2 y 4 mientras los frascos 3, 5 y 6 permanecen sin modificaciones, todo después de incubar a la temperatura y tiempo incubado. Hay varias explicaciones posibles para esto, incluyendo una contaminación accidental del frasco 4. Por lo tanto, nunca se puede saber que ocurrió realmente y hay que proceder de la forma más simple ante una situación dudosa.
En el ejemplo anterior, si se confía razonablemente en que los frascos fueron rotulados apropiadamente con su número de orden, el informe será 104 bact/mL anotando el frasco que “saltó”.
Características de los cultivos puros
Las colonias deben ser iguales en forma, tamaño y color.
Que no existan formas inhibidas.
Al microscopio deben tener un aspecto común.
Tiene que tener iguales propiedades tintoriales
Deben ser bioquímicamente y fisiológicamente iguales..
Una regla importante es no coger nunca de la primera colonia.
Técnica de la siembra
La técnica para el aislamiento comienza preparando un inóculo de siembra, que es la deposición de una pequeña porción de la muestra en el medio o en los medios de cultivo adecuado, en función de las especies microbianas que se espera encontrar. Por eso existen distintos métodos o tipos de siembra, en función de la muestra de partida, del medio en el que se siembra y de la finalidad del estudio. Describiremos la siembra para inoculación y la siembra para aislamiento.
Siembra para inoculación: la inoculación consiste en tomar una pequeña porción de la muestra y diluirla para dispersarla y que crezca con más facilidad en el medio de cultivo. Se puede inocular en medio líquido o en medio sólido.
Siembra para aislamiento: la finalidad de este tipo de siembras es la de obtener cultivos puros. Se siembra en placa de Petri que contienen medios de cultivo sólidos.
Existen varios tipos de siembras para aislamiento:Siembra en estría o zig-zag, siembra por estría múltiple, siembra de los cuatro cuadrantes, siembra de los tres giros.
Métodos para obtener los cultivos puros
Método de siembra para aislamiento por agotamiento o en estría
Materiales
Placa petri con medio de cultivo
Muestra (sólida o líquida)
Asa de siembra de platino
Con el asa estéril tomamos la muestra y hacemos extensiones en la placa. Volvemos a esterilizar el asa de siembra y extendemos parte de la extensión anterior en otra dirección. Volvemos a esterilizar el asa de siembra y volvemos a extender parte de la segunda extensión en otra dirección. Esterilizamos y repetimos la operación. Incubamos a 37 º durante 24 horas y, en la primera zona, habrá un amasijo de células. En la segunda, parte de la primera zona estará mejor extendida, y en la tercera y en la 4ª mejor aún. Si tomamos una colonia y la ponemos sobre una placa petri, tendremos un cultivo puro.
Estría única: depositamos la muestra lo más alejado de nosotros y realizamos la siembra en forma de zig-zag. De esta forma vamos descargando la muestra del asa. Es importante no volver a repasar el trozo de medio de cultivo que ya hemos sembrado. Para conseguir que al final de la estría tengamos colonias aisladas es importante que al principio hagamos la estría más junta y que la cantidad de muestra tomada en el asa sea la adecuada.
Estría múltiple: en esta técnica de aislamiento por agotamiento se realizan varias estrías. Esto se puede llevar a cabo flameando el asa de paso en paso, es decir, de estría en estría, o sin flamear el asa. Además, dependiendo de la forma en la que hagamos las estrías, existen varios tipos de estriados:
Estriado sobre cuatro cuadrantes: Se utiliza cuando queremos conservar algún microorganismo que nos interesa. Consiste en sembrar uno a uno los cuadrantes, sin flamear el asa entre estría y estría, de tal forma que en el cuarto cuadrante, al ir agotando la muestra del asa, tendremos los microorganismos aislados.
Esterilizando asa entre siembra y siembra: consiste en realizar un primer estriado en uno de los extremos de la placa, esterilizar el asa, girar un poco la placa y realizar otro estriado introduciendo el asa en el primer estriado para ir arrastrando la muestra y volver a repetir esta operación con un tercer estriado:
Sin esterilizar el asa entre siembra y siembra: Se lleva a cabo igual que en el caso anterior salvo en que en esta técnica no se flamea el asa entre la realización de los estriados y por lo tanto no es necesario arrastrar la muestra de las primeras siembras.

Método de siembra para aislamiento por diluciones sucesivas
Consiste en diluir una muestra hasta conseguir muy pocas células que, tras inocularse en un medio de cultivo, generen colonias aisladas.
Metodología: ahora tomamos 0.1 ml de cada tubo y lo depositamos en una placa petri con medio de cultivo. Con un asa de vidrio se extiende esa cantidad sobre la placa, e incubams a 37 ºC durante 24 horas.
En la primera dilución habrá un amasijo de colonias. En la siguiente habrá diez veces menos número de colonias, y así sucesivamente hasta conseguir colonias aisladas. Este método nos permite calcular el número de microorganismos viables que existen en la muestra que estamos analizando: N=C · 1/D · 1/i
donde:
N es el número de microorganismos presentes en la muestra
C es el número de colonias contadas UFC (unidades formadoras de colonias)
D es la dilución
I es el inóculo
Debe haber entre 30 y 300 colonias. Si hay menos, no es significativo (puede tratarse de una contaminación) y, si hay más, no están aisladas.
Técnica del cultivo por enriquecimiento
Consiste en ajustar las condiciones de cultivo para seleccionar el microorganismo que nos interesa aislar. Ejemplo: nos interesa aislar bacterias fotoautótrofas. Tomamos un matraz con agua y sales y lo incubamos a la luz, de manera que crezcan las bacterias fotoautótrofas. Ejemplo: queremos aislar bacterias quimiolitótrofas del azufre; ponemos azufre, CO2 como fuente de carbono (disuelto en agua) e incubamos en la oscuridad para eliminar fotoautótrofos. Para incubar enterobactrias como enterobacter hay que incubar a 37º, mientras que para incubar otra enterobacteria, E. Coli, hay que incubar a 45º.
Conservación de cultivos puros
Almacenamiento a temperaturas bajas. Ponemos las bacterias con glicerol al 20 - 50% a -70º y podemos mantenerlas así durante años y décadas.
Liofilización: es un método más eficaz. En un vial de liofilización ponemos leche desnatada y las bacterias, lo congelamos, lo llevamos al liofilizador y lo sometemos al proceso de liofilización. La liofilización es una evaporación por condensación. Se basa en el punto triple del agua; podemos pasar de sólido a gas. El agua se evapora y queda un polvillo formado por la leche y las bacterias. Cerramos el bote y podemos almacenar el cultivo durante décadas.
Colecciones de cultivo: en todos los países hay organizaciones que preparan o almacenan colecciones de cultivos puros o tipo. En España existe la C.E.C.T (Colección española de cultivos tipo), que está en Valencia. La más grande del mundo es la americana, A.T.C.C. (American type cultive collection).
Mantenimiento
Debemos transferir periódicamente, ya que los tubos de agar se secan, se evapora el agua.
Se debe cubrir con parafina, con lo cual la transferencia se puede hacer más tarde, disminuye el metabolismo y tardan en envejecer.
Se disminuye la temperatura, congelamos las células. Para proteger las células y que no se formen cristales que las dañen se usa el glicerol
La liofilización es la sublimación a alto vacío de las muestras congeladas con rapidez.
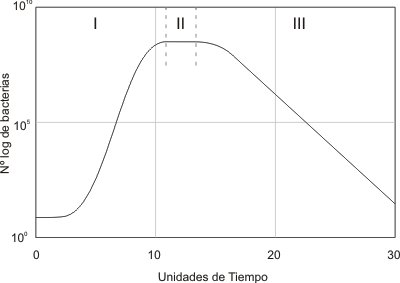
Curvas de Crecimiento Microbiano
El concepto asociado al Crecimiento Microbiano, corresponde al aumento poblacional de una especie microbiana en un medio de cultivo provisto de todas las necesidades del microorganismo (Cantidad de Nutrientes, Temperatura, Grado de Humedad, Gases y pH).
Las curvas de Crecimiento Microbiano constan de 4 etapas bien definidas, aunque el tiempo de duración de cada una de estas etapas, puede variar según el tipo de microorganismo, la familia a la cual este pertenece, entre otras características.
Fase de Latencia: Corresponde a un período de transición para los microorganismos cuando son transferidos a una nueva condición. En esta fase no hay incremento en el número de células, aunque sí una gran actividad en el metabolismo.
Fase de Crecimiento Exponencial: Período en que el crecimiento del microorganismo ocurre de forma exponencial, es decir, cada vez que pasa un determinado tiempo la población se duplica.
Fase Estacionaria: Período en que ocurren las limitaciones del crecimiento, ya sea por agotamiento de algún nutriente esencial, por acumulación de productos tóxicos o por una combinación de las causas anteriores.
Fase de Muerte: Luego que culmine la fase estacionaria, comienza una progresiva disminución en el número de celulas viables, cuando esto ocurre se dice que la población ha entrado en fase de muerte.
TIPOS DE CURVAS DE CRECIMIENTO MICROBIANO
Pruebas bioquímicas
En el laboratorio disponemos de numerosas técnicas para la caracterización bioquímica de una especie
Kligler Hierro Agar Medio de cultivo frecuentemente usado en microbiología de alimentos para la diferenciación de enterobacterias, en base a la fermentación de glucosa y lactosa, y a la producción de ácido sulfhídrico. Fórmula (en gramos por litro) Instrucciones Peptona de carne 13.0 Cloruro de sodio 5.0 Suspender 54.8 g del polvo por litro de Lactosa 10.0 agua destilada. Mezclar bien y calentar Tripteina 10.0 con agitación frecuente, hervir 1 o 2 minutos hasta disolución total. Llenar Glucosa 1.0 hasta la tercera parte de los tubos de Citrato de hierro y amonio 0.5 ensayo. Esterilizar a 121 C por 15 Tiosulfato de sodio 0.3 minutos. Enfriar en pico de flauta profundo. Rojo de fenol 0.025 Agar 15.0 pH final: 7.3 0.2
TSI Agar Medio universalmente empleado para la diferenciación de enterobacterias, en base a la fermentación de glucosa, lactosa, sacarosa y a la producción de ácido sulfhídrico. Fórmula (en gramos por litro) Instrucciones Extracto de carne 3.0 Pluripeptona 20.0 Cloruro de sodio 5.0 Suspender 62,5 g del polvo por litro Lactosa 10.0 de agua destilada. Mezclar bien y calentar con agitación frecuente, Sacarosa 10.0 hervir 1 o 2 minutos hasta disolución Glucosa 1.0 total. Llenar hasta la tercera parte de los tubos de ensayo. Esterilizar a Sulfato de hierro y amonio 0.2 121 C por 15 minutos. Enfriar en pico Tiosulfato de sodio 0.2 de flauta profundo. Rojo de fenol 0.025 Agar 13.0 pH final: 7.3 0.2
Lisina Hierro Agar Medio de cultivo utilizado para diferenciar microorganismos, especialmente Salmonella spp., basado en la decarboxilación / desaminación de la lisina y en la producción de ácido sulfhídrico. Fórmula (en gramos por litro) Instrucciones Peptona de gelatina 5.0 Suspender 35 g del medio Extracto de levadura 3.0 deshidratado en un litro de agua Glucosa 1.0 destilada. Dejar embeber unos 15 minutos. Calentar cuidadosamente, Lisina 10.0 agitando con frecuencia y hervir Citrato de hierro y amonio 0.5 durante un minuto hasta la disolución completa. Distribuir y esterilizar a Tiosulfato de sodio 0.04 121 C durante 15 minutos. Enfriar en Púrpura de bromocresol 0.02 pico de flauta dejando un fondo vertical apto para la punción. Agar 15.0 pH final: 6.7 0.2
MIO Medio Medio usado para la identificación de Enterobacteriaceae en base a su movilidad, actividad de ornitina decarboxilasa y producción de indol. Fórmula (en gramos por litro) Instrucciones Dextrosa 1.0 Extracto de levadura 3.0 Suspender 31 g del polvo en un Peptona 10.0 litro de agua destilada. Calentar Tripteína 10.0 a ebullición hasta completa Clorhidrato de L-ornitina 5.0 disolución. Distribuir en tubos y esterilizar 15 minutos a 121 C. Agar 2.0 Púrpura de bromocresol 0.02 pH final: 6.5 0.2
SIM Medio Es un medio semisólido destinado a verificar la movilidad, producción de indol y de sulfuro de hidrógeno en un mismo tubo. Es útil para diferenciar miembros de la familia Enterobacteriaceae. Fórmula (en gramos por litro) Instrucciones Tripteína 20.0 Suspender 30 g del polvo por litro de agua Peptona 6.1 destilada. Mezclar hasta disolver; calentar agitando y hervir durante un minuto. Distribuir Sulfato de hierro y amonio 0.2 unos 4 ml en tubos de hemólisis y esterilizar Tiosulfato de sodio 0.2 en autoclave a 121 C durante 15 minutos. Agar 3.5 Solidificar en posición vertical. pH final: 7.3 0.2
Urea Medio utilizado para la identificación de microorganismos, en base a la actividad ureásica. Es particularmente útil para diferenciar Proteus spp. de otros miembros de la familia Enterobacteriaceae. Fórmula (en gramos por litro) Instrucciones Urea 20.0 Suspender 3, 87 g del medio Fosfato monopotásico 9.1 deshidratado por cada 100 ml de agua destilada. Disolver sin calentar Fosfato disódico 9.5 y esterilizar por filtración. Distribuir Extracto de levadura 0.1 en tubos pequeños estériles, entre 0,5 y 2 ml. Rojo fenol 0.01 pH final: 6.8 ± 0.2
Simmons Citrato Agar Medio utilizado para la diferenciación de enterobacterias, en base a la capacidad de usar citrato como única fuente de carbono y energía. Fórmula (en gramos por litro) Instrucciones Citrato de sodio 2.0 Cloruro de sodio 5.0 Suspender 24,2 g del medio deshidratado por litro de agua destilada. Fosfato dipotásico 1.0 Dejar reposar 5 minutos y mezclar Fosfato monoamónico 1.0 calentando a ebullición durante 1 o 2 Sulfato de magnesio 0.2 minutos. Distribuir en tubos y esterilizar en autoclave a 121 C durante 15 Azul de bromotimol 0.08 minutos. Enfriar en posición inclinada. Agar 15.0 pH final: 6.9 0.2
sábado, 18 de octubre de 2014
lunes, 13 de octubre de 2014
Suscribirse a:
Entradas (Atom)